Уравнение Клапейрона-Клаузиуса.
Кривая фазового равновесия. В состоянии равновесия двух фаз выполняется равенство  , где индексы 1 и 2 относятся к различным фазам одного вещества. Отсюда следует
, где индексы 1 и 2 относятся к различным фазам одного вещества. Отсюда следует 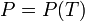 . Это значит, что равновесие может существовать, если только давление и температура в системе удовлетворяет указанному соотношению - лежит на кривой фазового равновесия.
. Это значит, что равновесие может существовать, если только давление и температура в системе удовлетворяет указанному соотношению - лежит на кривой фазового равновесия.
Найдем дифференциальное уравнение кривой фазового равновесия. При изменении  и
и  выполняются равенства
выполняются равенства
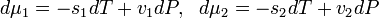
Поскольку 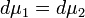 получаем
получаем
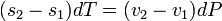
Введем обозначение: 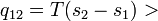 . Тогда
. Тогда
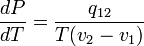
Это соотношение называется уравнением Клапейрона-Клаузиуса.
Величина 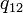 - называется теплотой фазового перехода
- называется теплотой фазового перехода  .
.